Maddeyi meydana getiren parçacıklara atom denilmektedir. Atomların özellikleri birbirine göre farklılık gösterdiğinden dolayı çeşitli atom modelleri oluşturulmuştur ve bu atom modelleri arasında Dalton, Thomson, Rutherford, Bohr, modern atom modelleri yer alır. Düne kadar atom maddenin en küçük yapı taşı olarak kabul ediliyordu çünkü atomların bölünemeyeceği düşünülüyordu ancak yıllar sonra ilerleyen teknolojiyle birlikte atomların dahi parçalanabileceği kanıtlandı. Bu da atomdan daha küçük yapıların olduğunu gösterdi. Bu nedenden dolayı çeşitli atom modelleri ve özellikleri ayrı başlıklar altında incelenmeye başladı.
Atom Nedir?
Atom, maddeyi meydana getiren en temel yapı taşıdır. Dünya genelinde belirlenmiş toplamda 105 adet element bulunmaktadır ve bu elementlerin tamamı atomlardan meydana gelmektedir. Elementler bileşiklerle karıştırılmamalıdır çünkü bileşikler birbirinden farklı elementlerin bir araya gelmesiyle elde edilir. Yeryüzünde yer alan elementlerin farklı özelliklere sahiptir ve özelliklerinin farklı olmasının en büyük nedeni atomsal özelliklerinin farklı olmasıdır. Elementler hakkında net bilgiler elde edilebilmesi için kesinlikle temel yapı taşları olan atomların iyi bir şekilde incelenmesi gerekiyor.
Dalton Atom Modeli ve Özellikleri
Bu atom modeli 19. Yüzyılda ünlü bilim insanı John Dalton tarafından oluşturuldu. Kendisine göre atomlar içi dolu birer küreden ibaretti ve çeşitli özellikleri vardı. Dalton atom modelinin özellikleri şu şekildedir.
- Elementlerin tamamı bölünemeyen ve küre şeklinde olan parçacıklardan yani atomlardan meydana gelir.
- Herhangi bir elementin içerisinde yer alan atomların tamamı büyüklük, özellik ve kütle bakımından birbirinin tamamen aynısıdır.
- Atomların parçalanması mümkün olmadığı gibi yeniden oluşturulmaları da mümkün değildir.
- Atomlar bir araya gelerek bileşikleri meydana getirir.
- Bileşiklerin içerisinde yer alan moleküllerin tamamı birbirinin aynısıdır.
Thomson Atom Modeli ve Özellikleri
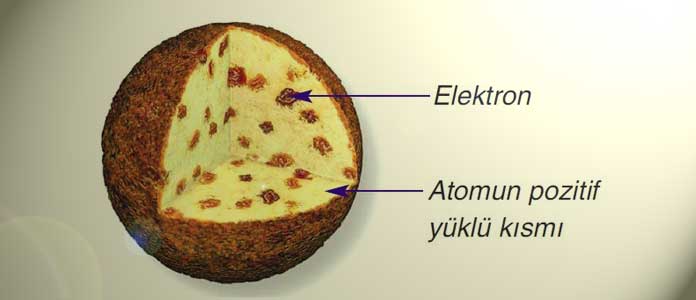
Atomun daha küçük yapıdaki parçacıklardan oluştuğunu söyleyen Joseph John Thomson, bu görüşünü 1897 yılında ortaya atmıştır. Kendisi atomu tanımlarken üzümlü kek benzetmesi yapmıştır. Kekin ana kısmının pozitif yükü, üzümlerinse negatif yükü temsil ettiğini söylemiştir. Joseph John Thomson atomların içerisinde yer alan elektronların yük /kütle oranını ölçmeyi başararak atomun daha küçük parçacıklardan meydana geldiğini kanıtlamıştır. Kendisinin bulmuş olduğu bu atom modeline Thomson atom modeli denilmektedir ve özellikleri şu şekildedir.
- Elementlerin içerisinde yer alan atomlar yaklaşık olarak 10 üzere -8 santimetre büyüklüğündedir.
- Atomlar nötr yüklüdür çünkü eksi yükleri karşılayacak kadar artı yüklere sahiptir.
- Elektronlar çok küçük yapıda oldukları için görmezden gelinebilirler çünkü atomların büyük kısmı protonlar meydana getirmektedir.
Rutherford Atom Modeli ve Özellikleri
Güneş sistemine olan benzerliğiyle dikkat çeken bu atom modeli 1911 yılında Ernest Rutherford tarafından ortaya atılmıştır. Genel olarak bu atom modelinde güneş, içerisinde proton dolu çekirdek kısmı simgelerken, güneşin etrafında dönmekte olan gezegenler elektronları temsil etmektedir. Rutherford atom modelinin özellikleri tanımlamak isteyen Ernest Rutherford, bir levha üzerine alfa taneciklerini gönderdi ve bunların davranışlarını izledi. Bu davranışlar sonrasında elde edilen Rutherford atom modelinin özellikleri şu şekildedir.
- Atomun sahip olduğu pozitif yükler çekirdek olarak nitelendirilen merkez kısımda yer alır.
- Çekirdeğin etrafında yer alıp, dairesel olarak bir yörüngede dönen parçacıklar elektronlardır.
- Elektronların yer aldığı hacim çekirdeğin hacminden daha büyüktür.
- Atomun çekirdeğinde yer alan pozitif yükler aynı elementin diğer atomlarında da aynıyken, farklı elementlerde farklıdır.
- Çekirdekte yer alan yük miktarı elektron miktarına eşit sayıdadır.
Bohr Atom Modeli ve Özellikleri
Bu atom modelinde hidrojen atomları incelendi ve elde edilen bilgilere göre Bohr atom modeli oluşturuldu. Ünlü bilin insanı olan Bohr, bu atom modelini oluşturmadan önce yapmış olduğu gözlemlerde atomların farklı dalga boylarında ışımalar yapmasının, elektronların enerji seviyeleri arasındaki geçişlerinden ötürü meydana geldiğini düşündü. Bu doğrultuda bir atom modeli oluşturdu. Bohr atom modeli özellikleri de kısaca şu şekildedir.
- Elektronlar çekirdek etrafında belirli bir uzaklıkta bulunmaktadır.
- Elektronların yer aldığı yörüngelerin enerjileri birbirinden farklıdır.
- Yüksek enerji yörüngesinde düşük enerji yörüngesine bir elektron geçişi olursa, bu durum sonucunda enerji farkına eşit şekilde ışın yayılmaktadır.
- Atomda yer ala elektronların tamamı düşük enerji seviyesine geçmeye eğilimlidir. Bir atom ısıtıldığı zaman elektronlar yüksek enerji düzeyine geçiş yapar ve bu durum da elektronları aşırı derecede duyarlı hale getirir.
- Çekirdekten uzaklaştıkça enerji düzeyi artan toplamda 7 enerji düzeyi bulunmaktadır. Düşük enerjiden yüksek enerjiye doğru 1, 2, 3, 4, 5, 6, 7 şeklinde yapılan sıralamada 1 en düşük enerjiyi 7 ise en yüksek enerjiyi temsil eder. Ayrıca enerji yörüngeleri K, L, M, N, O, P, Q şeklinde de ifade edilmektedir.
Modern Atom Modeli ve Özellikleri
Bu atom modelinde, diğer atom modellerinde yer alan eksiklikler giderildikten sonra bir model oluşturuldu. Atomlarla ilgili olarak yapılan son model olduğu gibi günümüzde de bu atom modeli kabul görmektedir. Bu atom modelinin özellikleri incelendiği zaman modern atom modeli daha iyi bir şekilde anlaşılacaktır.
- Elektronların konumu ile hızı aynı anda tespit edilemediğinden dolayı elektronların çekirdeğin etrafında yer aldığı kabul edilir.
- Pozitif olarak yüklenmiş olan çekirdeğin etrafında yer alan elektronlar çeşitli katmanlar halindedir ve bir elektron bulutu meydana getirirler. Oluşan bu elektron bulutuna orbital adı verilir.
- Atom içerisinde yer alan elektronlar dalga özelliği göstermektedir.
- Herhangi bir enerji seviyesi ele alınacak olursa burada yer alan orbital sayısı n2 şeklinde ifade edilmektedir.
- Tüm enerji seviyelerinde orbital sayısının 2 katı elektron yer alır. Buradan yola çıkıldığında temel enerji seviyesinde maksimum 2n2 elektron yer alır denilmektedir.